一、实验原理及方法
使用电位滴定仪,络合滴定。用电位滴定法。
锌离子与EDTA有很高的络合常数,它们按照1:1进行络合产生络合物。
钙离子与EDTA有很高的络合常数,它们按照1:1进行络合产生络合物。
因为没有锌电极,我们采用反滴定法。
标准参照GB 8820-2010 食品安全国家标准食品添加剂 葡萄糖酸锌
二、滴定使用
仪器:ZDJ-5型自动滴定仪
电极:pCa-1型钙离子选择电极 232-01型电极为参比电极
三、试剂(略)
3.1 葡萄糖酸锌(C12H22O14Zn)C(Zn)=0.02mol/L:准确称取0.9100g(实际0.9103)溶解。在容量瓶中定容至100ml。
3.2钙标准溶液C(Ca)=0.02mol/L:将CaCO3准确称取1.001g,加入少量蒸馏水润湿。逐滴加入4 mol/L盐酸的盐酸至碳酸钙完全溶解,避免过量。加200ml水煮沸数分钟赶除二氧化碳。在容量瓶中定容至500ml。
3.3乙二胺四乙酸二钠C(EDTA)=0.05mol/L:将EDTA在80℃下干燥2小时,取出放在干燥器中冷却至室温。称取EDTA4.650g,在容量瓶中定容至250ml。
四、EDTA浓度的标定步骤及结果分析
4.1EDTA浓度的标定:
吸取5ml钙标准溶液,用EDTA溶液在自动电位滴定仪上滴定至电位突跃,记录所消耗的EDTA溶液的体积。
4.2分析结果计算
EDTA的浓度用C1表示
C1=C2×V2/V1
式中:C2—钙标准溶液的浓度,0.02mol/L
V2—钙标准溶液的体积(ml):
V1—EDTA的体积(ml)
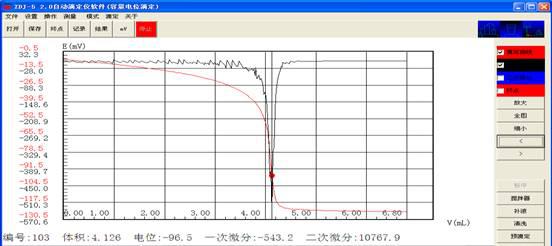
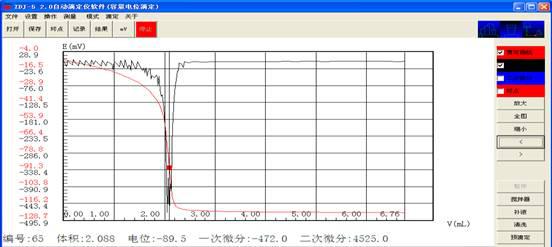
V2:10ml 5ml V1:4.126 2.088 C1:0.0485 0.479
故C(EDTA)=0.0482 mol/L
每5ml钙标液消耗2.075ml
五、葡萄糖酸锌中锌含量的滴定
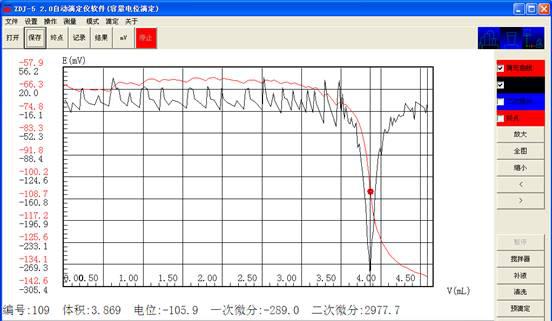
吸取葡萄糖酸锌溶液和钙标准溶液各5ml,用EDTA溶液在自动电位滴定仪上滴定至电位突跃,记录所消耗的EDTA溶液的体积。
因钙标准溶液消耗EDTA2.075 ml,所以锌样消耗1.794
六、指示剂法测定锌含量
此组实验是用来比对电位滴定法的准确性的。
平行三次,体积分别为:1.809ml,1.808ml, 1.806 ml。
七、葡萄糖酸锌中锌含量的计算
每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当于22.78mg的C12H22O14Zn。每5ml葡萄糖酸锌溶液中含量为45.79mg。
葡萄糖酸锌含量=22.78m×CEDTA/0.05×Vzn
CEDTA=0.0482
Vzn:滴定中锌消耗体积
滴定中锌消耗体积:1.794
葡萄糖酸锌含量: 39.40
C12H22O14Zn%: 86.04%
手动平行三次,体积分别为:1.809ml, 1.808ml, 1.806 ml
葡萄糖酸锌含量:39.72 39.69 39.65
C12H22O14Zn%: 86.74% 86.68% 86.59 %
手动滴定因肉眼观察终点稍微偏后,滴定结果与电位滴定数据基本一致,可认为数据是准确的。










