色谱仪柱效下降的表现一般是峰变宽和峰高下降,有的时候会出现分叉峰。造成柱效下降的原因很多,很多时候我们会想到柱子的问题,其实溶剂与流动相的不匹配会造成柱效下降。本文主要说明溶剂造成柱效下降和峰分叉的原因。
一、实验
仪器:高效液相色谱仪配自动进样器,UV/vis检测器;C18色谱柱,4.6×250mm,5μm。
试剂:分析物F(易溶于甲醇和冰醋酸,微溶于乙醇和水,进样用80%的甲醇溶解),磷酸二氢钠(分析纯),乙睛(色谱纯),甲醇(分析纯)。
检测条件:检测波长214nm,缓冲溶液0.01M磷酸二氢钠缓冲溶液;流动相:乙腈:缓冲盐=15:85。进样体积:100μl。
如图1,在缓冲溶液pH =5.0时出现分叉峰(图1),样品F浓度为2μg/ml。下调缓冲盐pH =3.0,仍然出现分叉峰(图2)。
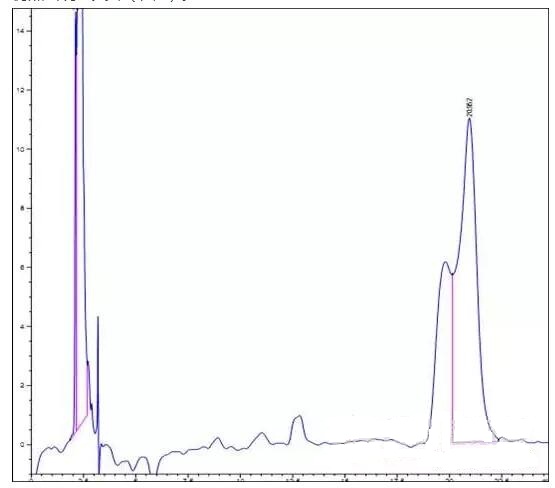
图1. pH=5.0色谱图
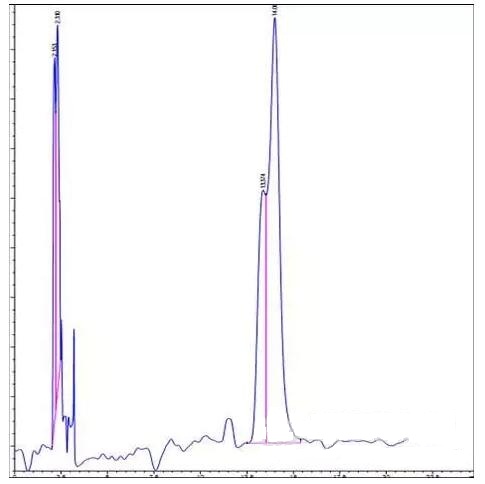
图2. pH=3.0色谱图
同时我们发现所有的杂质峰也都出现了分叉情况(图3)。

图3. 杂质峰也出现分叉
二、原因分析
是什么原因造成了这种现象呢?
首先想到的是大体积进样造成的(因为进样20μl不能检测到所分析物质F浓度)进样100μl一般会造成峰扩展,柱效下降,如果降低进样量还会出现分叉峰吗?实验结果如图4。进样体积减小,峰分叉的情况逐渐改善,在进样50μl的情况下,形成了肩峰(图4小图),进样40μl肩峰消失。
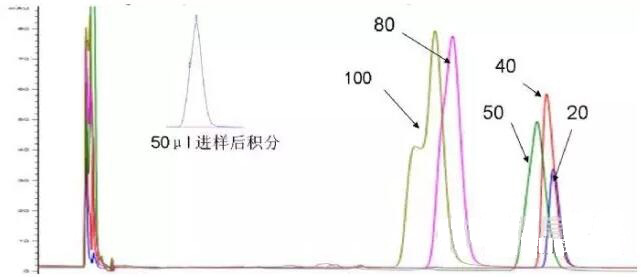
图4 依次进样20,40,50,80,100μl的色谱图。小图为50μl进样后积分,该图显示色谱峰有肩峰
一般来说,加大进样体积,峰会展宽很多,分离度降低,柱效下降(极端情况下如果是微柱或者UPLC会看不到峰),不会出现峰分叉,分叉峰是怎么形成的呢?更奇怪的是进样体积越大,出峰时间越靠前,在进样100μl和进样20μl的情况下,出峰时间相差4分钟,为什么进样体积会影响出峰时间?
造成这些现象的原因只有一个:溶解分析物F的溶剂,增加进样体积只是放大了溶剂影响。在我们的实验中,溶剂采用80%的甲醇溶解,而流动相是15%的乙腈,在反相色谱中,80%的甲醇洗脱能力强于15%的乙腈,就是说溶解F的溶剂极性小于流动相的极性。当样品进入色谱后,一部分分析物质会和固定相结合,一部分还没有和固定相结合就被洗脱能力强的溶剂带着沿流动方向移动(色谱柱纵轴),这样分析物就发生了扩散(图5扩散),当进样体积加大,进入色谱系统的溶剂会改变色谱柱的流动相组成,甚至会顶替掉流动相(图5溶剂替代),在溶剂的洗脱下,出峰时间就会提早,溶剂里的分析物F和在色谱过程开始的与固定相结合的分析物F会先后流出,这样就形成了分叉峰(图5检测)。
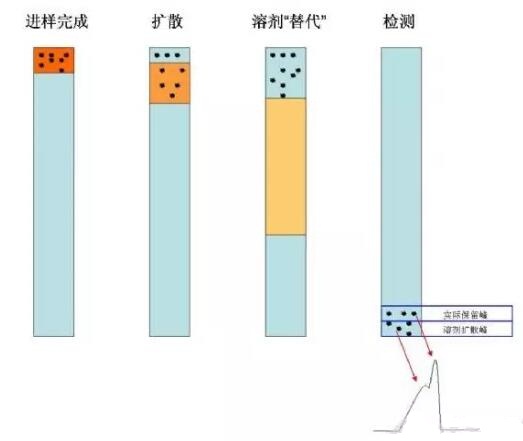
图5.溶剂造成的峰扩散和峰分叉过程。橘黄色为溶剂,黑色为分析化合物,淡蓝色为色谱
三、结论
1. 溶解分析物的溶剂最好使用流动相或者洗脱能力比流动相小的溶剂,避免峰展开。
2. 考虑到分析物溶解性,如果选用洗脱能力比流动相强的溶剂,尽量减小进样体积,避免对色谱造成大的扰动。
3. 如果目标是能检测2μg/ml的浓度,而现有分析方法的定量限LOQ是10μg/ml,请慎重使用加大进样量的改进方法,加大进样量会产生很多意想不到的问题,结果通常是进样量加大5倍,LOQ一般不会提高5倍。
(内容来源液相色谱之家)










