一、实验原理及方法
使用电位滴定仪,络合滴定。用电位滴定法。
钙离子与EDTA有很高的络合常数,它们按照1:1进行络合产生络合物。
二、使用仪器
电极:pCa-1型钙离子选择电极、232-01型电极做参比电极
三、 试剂
3.1 氨水 AR
3.2 盐酸:4 mol/L
3.3钙标准溶液C(Ca)=0.02mol/L:将CaCO3在150℃下干燥2小时,取出放在干燥器中冷却至室温,准确称取1.001g,加入少量蒸馏水润湿。逐滴加入4 mol/L盐酸的盐酸至碳酸钙完全溶解,避免过量。加200ml水煮沸数分钟赶除二氧化碳。在容量瓶中定容至500ml。
3.4乙二胺四乙酸二钠C(EDTA)=0.02mol/L:将EDTA在80℃下干燥2小时,取出放在干燥器中冷却至室温。称取EDTA3.7g,在容量瓶中定容至500ml。
3.5 pH=10的NH3-NH4CL缓冲溶液:称取5.4g氯化铵,加入35ml氨水,定容至100ml。
四、EDTA浓度的标定步骤及结果分析
4.1EDTA浓度的标定:
吸取10ml钙标准溶液于250ml烧杯中,加蒸馏水至50ml,加入10mlNH3-NH4CL缓冲溶液,用EDTA溶液在自动电位滴定仪上滴定至电位突跃,记录所消耗的EDTA溶液的体积。
4.2分析结果计算
EDTA的浓度用C1表示
C1=C2×V2/V1
式中:C2—钙标准溶液的浓度,0.02mol/L
V2—钙标准溶液的体积(ml):10 ml
V1—EDTA的体积(ml)
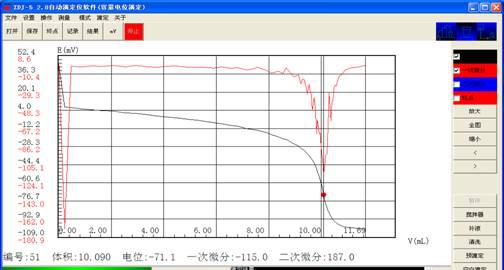
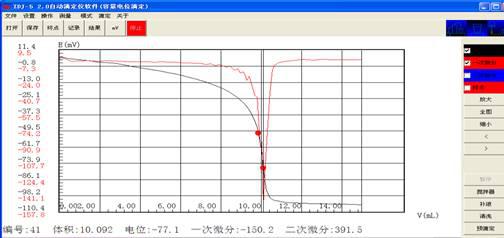
V1:10.090 10.092
C1:0.0198 0.0.0198
故C(EDTA)=0.0198 mol/L
五、 牛奶中钙含量的标定及结果计算
5.1优+中钙含量的标定及计算
5.1.1优+中钙含量的标定
用移液管移取1ml牛奶于250ml锥形瓶中,将移液管清洗几次,将清洗液也导入锥形瓶中,加水至50ml,加入10mlNH3-NH4CL缓冲溶液。用EDTA溶液在自动电位滴定仪上滴定至电位突跃,记录所消耗的EDTA溶液的体积。
5.1.2优+中钙含量的计算
牛奶中钙含量用C表示 : C=C1×V1×A×1000/V0
式中:C1—EDTA溶液的浓度,0.0198mol/L V1—EDTA的体积(ml)
A—钙的原子质量(40.08) V0—试样的体积(ml):1 ml

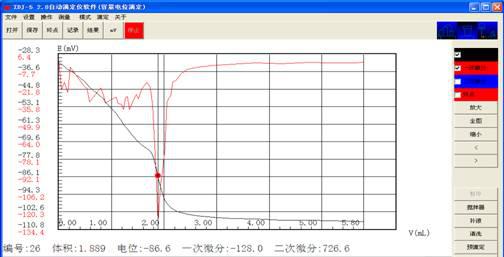
V1:1.891 1.889
C= 0.0198×1.891×40.08×1000/1=1500.67mg/L
C= 0.0198×1.889×40.08×1000/1=1499.08mg/L
5.2高钙中钙含量的标定及计算
5.1.1高钙中钙含量的标定
用移液管移取1ml牛奶于250ml锥形瓶中,将移液管清洗几次,将清洗液也导入锥形瓶中,加水至50ml,加入10mlNH3-NH4CL缓冲溶液。用EDTA溶液在自动电位滴定仪上滴定至电位突跃,记录所消耗的EDTA溶液的体积。
5.1.2高钙中钙含量的计算
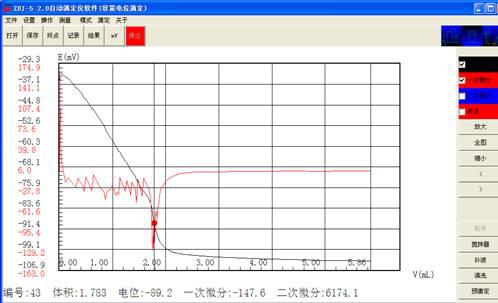
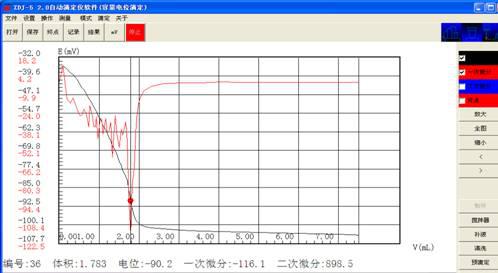
V1:1.783 1.783
牛奶中钙含量用C表示 :
C=C1×V1×A×1000/V0
式中:C1—EDTA溶液的浓度,0.0198mol/L
V1—EDTA的体积(ml)
A— 钙的原子质量(40.08)
V0—试样的体积(ml):1 ml
C= 0.0198×1.783×40.08×1000/1=1414.96mg/L
C= 0.0198×1.783×40.08×1000/1=1414.96mg/L
牛奶的参考值是1400 mg/L
六.方法讨论
(1)在用移液管移取牛奶的时候因为牛奶很容易粘附在移液管管壁,所以应用去离子水清洗几次,然后将清洗液一起加入锥形瓶内一起滴定。
(2)牛奶比较容易粘附电极,所以在每一次滴定结束后应用清水反复清洗几次。
文章来源雷磁官网。










